聚合酶链式反应(polymerase chain reaction),简称PCR,是众所周知的分子生物学技术之一。其作为一种通用检测技术,在诸多领域得到应用,可以涉及:植物检疫(植物病虫害),动、植物种类分类鉴定,转基因动、植物检测、动物疫病检测,病原微生物检测(例如:新冠病毒检测)、过敏原检测、转基因食品检测,濒危物种鉴定、公安刑侦鉴定,亲子鉴定,考古研究、新生儿遗传疾病筛查、健康人群基因缺陷筛查等检测技术领域。
对于PCR技术检测结果质量的影响因素,目前有很多报道。综合起来PCR检测质量的影响因素可能大致源于人员、仪器、方法、环境、试剂等五个方面。本文的关注重点不是这些质量影响因素,而是PCR设备本身性能对于检测结果的影响。
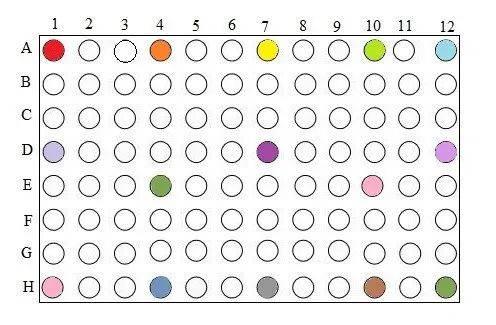
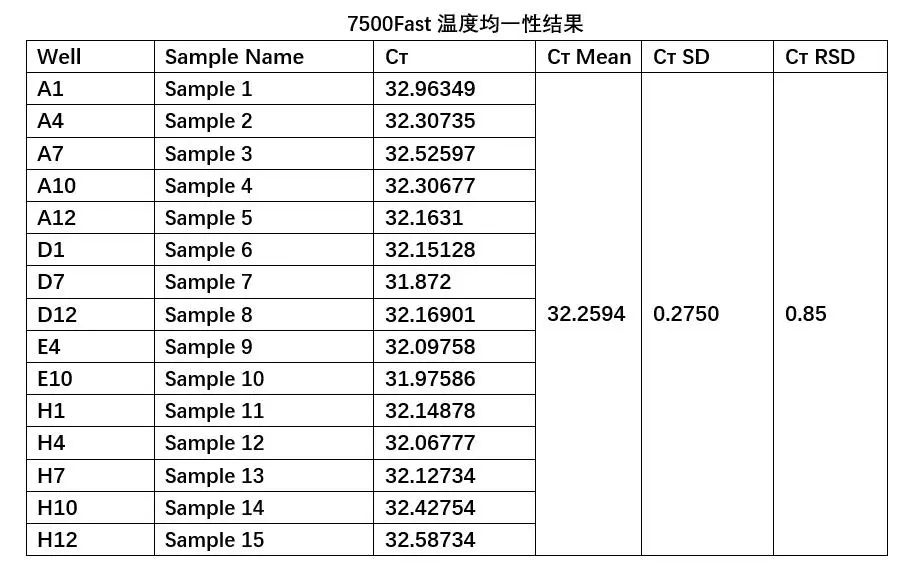
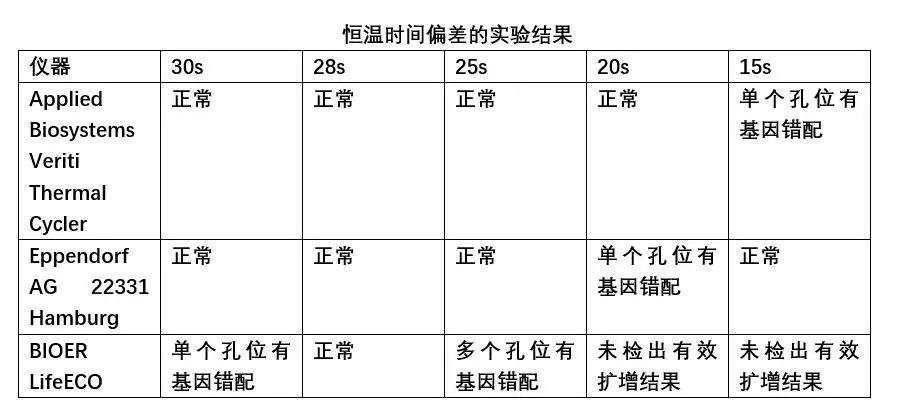
参编作者使用不用厂家、不同型号的PCR仪,对于PCR仪温度偏差、温度均匀性、PCR仪器的恒温时间(Hold-Time)等方面进行了试验研究和结果分析。 1 PCR仪温度准确性影响的研究 参编作者使用不同基因片段,包括:新冠假病毒片段、转基因玉米MON863基因片段,细菌毒力基因片段等开展了温度偏差影响的研究。研究中使用的设备涉及:7500FAST定量PCR仪(ABI公司、CFX96™ Real-Time System(BIO-RAD公司)、Roche 480(罗氏公司)等。研究中使用含以上基因片段的标准品或质控品,按照日常检测的标准方法或技术规范给出的PCR扩增程序进行目标片段的扩增。 研究中人为将程序中规定的温度调高或调低1°C、2°C、3°C、5°C等,模拟反应池温度与规定值有偏差的反应条件,探索其对扩增结果和Cт值影响。试验结果显示,当实验研究使用的模版浓度较高时,温度偏差对PCR扩增效果的影响不明显。但使用中低浓度模板时,温度偏差对PCR扩增效果有影响。 例如,在低浓度样品浓度的试验研究中,使用含转基因玉米MON863基因片段的标准品,即将MON863质粒DNA采用10倍梯度稀释至浓度为0.8 copies/μL,此时测定的标准曲线R2为0.999,扩增效率为104%,说明该标准曲线具有良好的线性关系,因此,选取该浓度水平作为低浓度测试水平。以此为弱阳性样品,按照《SN/T 1196-2018 转基因成分检测玉米检测方法》的规定的扩增程序进行实时荧光PCR检测,对不同温度偏差下的CT进行汇总和统计分析后,结果显示:对于AB 7500仪器而言,当反应程序整体温度调高1℃、整体温度降低1℃、时,AB 7500仪器检测弱阳性样本CT值存在差异,说明当AB 7500仪器温度变化时,弱阳性样本检测CT值受到影响。标准程序温度整体调高1℃至调低1℃,弱阳性样本均检出,检出率和结果判定未受到影响,但是弱阳性样本检测CT值受到影响,说明弱阳性样本的拷贝数在一定范围内时,AB7500仪器的温度整体变化后检出率不受影响,但是当弱阳性样本的拷贝数降低到某个的临界值时,AB7500仪器的温度整体变化后,弱阳性样本的检出率将会受到影响。 使用CFX96™ Real-Time System进行的实验结果,与上述结论类似。采用其他片段(新冠病毒基因片段、细菌StxI基因片段)和仪器(Roche 480)试验后,对于中低浓度模板的实验结果也呈现上述趋势。但对于双链DNA的扩增,在引物和酶充足的情况下,对温度的需求比较宽泛,尤其是当扩增中涉及的温度点比较少,控温时间短的反应条件,对温度的影响不敏感。 2 温度均一性对检测结果影响的研究 为了了解反应池不同孔位置差异对扩增效果的影响,即反应池不同部位扩增效果的差异,参编作者进行了温度均一性影响的测试。使用转基因玉米MON863基因片段,选取低浓度(0.8copies/μL)的质粒DNA溶液作为检测样品,即低浓度模板样品,样品放于仪器上可能出现温度差异的位置,摆放位置为1A、1D、1H、4A、4E、4H、7A、7D、7H、10A、10E、10H、12A、12D、12H,详细见图1,7500FAST定量PCR仪及CFX96™ Real-Time System两个品牌仪器同时进行了测试。 样品摆放位置图 下表是使用7500 Fast进行温度均一性测试的结果,整体来看,A1的CT值与其他位置相比较为最高,H12次之。说明板位的A1、H12与其他位置相比可能存在温度差异。 横向对比来看:A1、A4、A7、A10、A12中A1的CT值最大,A7次之,其他位置相近;D1、D7、D12中,D7的CT值最小,D1、D12相近;E4、E10的CT值相近,且与D7的CT值也相近;H1、H4、H7、H10、H12中H12的CT值最大,H1次之,其他位置相近。结果说明位于板位中间位置温度相较于边缘位置可能更均匀。 纵向对比来看:A1、D1、H1中A1的CT值最大,D1、H1相近;A4、E4、H4中A4的CT值最大,E4、H4相近;A7、D7、H7中A7的CT值最大,D7、H7相近;A10、E10、H10中A10的CT值最大,E10、H10相近;A12、D12、H12中H12的CT值最大,A12、D12相近。说明纵向来看三个样品中中间的样品CT值有更低的趋势,板位的上方位置(A)样品的CT值相较于其他两个位置(D、H)更高,板位上方位置(A)温度与其他位置可能存在差异。 试验研究表明,在温度均匀性方面,7500 Fast与CFX96的两种设备的试验结论类似。7500 Fast板位中间温度具有更均匀的趋势,CFX96板位右下方温度可能与其他位置存在差异,当然不排除具体机器的差异。对两种设备的空间均匀性测试均表明,反应池不同孔位置存在扩增效果的差异。在试验中应尽量将检测样品置于板位中间位置,减少仪器所造成的系统误差。 3 PCR仪恒温时间(Hold-Time)偏差的影响研究 使用羊全基因组DNA,采用QIAGEN DNeasy Blood & Tissue Kit 试剂盒,提取羊肌肉组织DNA。为了验证恒温时间(Hold-Time)对扩增结果的影响,我们分别对每台PCR仪“变性-退火-延伸”三个步骤的恒温时间(Hold-Time)统一调整,分别调整为30s,28s,25s,20s,15s。将上一步5个批次获得的扩增结果进行测序分析,测序由ABI3730仪器完成。将得到的测序结果与模板序列进行BLAST比对,分析扩增产物的序列准确性(是否有基因错配)。 从上表中可以看出,BIOER LifeECO型号PCR仪在“变性-退火-延伸”三个步骤的恒温时间(Hold-Time)统一调节至25s时已经出现明显扩增结果异常,继续下调至20s、15s时出现扩增实验失败。也就是说,当设定温度上的恒温时间(Hold-Time)明显小于设定值(例如按照标准操作程序,变性、退火及延伸设定值应为30s,实际只有28s、25s、20s、15s时,即实际实验过程中恒温时间(Hold-Time)远达不到设定要求,会影响变性、退火及延伸等相关实验步骤中的聚合酶链式反应,进而造成实验结果出现不稳定状态(例如多个孔位出现基因突变错误),甚至造成整板样品的扩增实验失败。但不同类型设备的,在此方面的敏感性,也存在差异。在试验所使用的三种设备中,Applied Biosystems Veriti Thermal Cycler抗干扰性最强。 由以上实验结果,可以得出PCR仪器的恒温时间(Hold-Time)设定值与实际值之间偏差过大会造成对样品扩增结果的稳定性造成不良影响,甚至导致扩增实验失败。因此,需要关注PCR仪校准报告中恒温时间(Hold-Time)参数,如果该参数设定值与校准值偏差过大,需要在后续PCR实验过程中通过调整恒温时间(Hold-Time)来进行补偿。 4 结论与应对 参编作者通过使用大豆基因片段、细菌毒力基因片段的扩增试验,对PCR仪温度偏差影响的试验研究结果显示,当反应程序温度偏离时,不论那种设备,都会对扩增效果产生响应。当反应程序整体温度偏差为+1℃时,相较于标准反应程序下相同DNA浓度的CT值,7500 Fast、CFX96、Roche 480都表现为减少,但影响较小。当反应程序整体温度偏差为+2℃时,相较于标准反应程序下相同DNA浓度的CT值,有些仪器无目标DNA扩增,有些仍然能检出弱阳性样本,但CT值有显著变化;当反应程序温度偏差为-1℃,实验中涉及的仪器均能检出弱阳性样本。 不同仪器(性能合格)对于温度准确性的响应程度有差异,结果变化方向也不一定一致,可能与不同品牌光源信号等有关,但本试验表明7500 Fast 的温度准确性偏差为±1℃时对弱阳性样本测试结果不产生影响,CFX96 的温度准确性对弱阳性样本测试结果影响不明显。相较而言,在本试验中7500 Fast比CFX96控温精度更好。 虽然在使用Roche 480仪器,使用细菌毒理基因的试验研究结果显示,中强度阳性样本在标准程序温度整体调高4℃至调低9℃,中强度阳性样本检出率未受到影响,但是中强度阳性样本检测Ct值受到影响,并且当Roche 480仪器的温度整体变化(从标准程序温度整体调高4℃至调低9℃)后,中强度阳性样本检测Ct值随着温度调高而降低,随着温度的调低而升高,由此推测,如果做样本核酸的定量检测,样本核酸的定量检测结果将会受到影响,即影响到定量检测结果的准确性。在低浓度样品扩增中,同样显现了与大豆基因片段相同的趋势,即温度上升或下降后,对检测结果阴阳性产生了颠覆性影响。 以上结果说明,不论仪器品牌、型号如何,对反应程序温度准确性都有响应。值得关注的是:不论是大豆基因片段还是细菌毒力基因片段,无论是何种设备,在温度发生2℃或3℃偏差时,均对扩增结果产生的影响,有些时候是弱阳性样本不能检出的颠覆性影响。 由此可见,温度偏离程序设定目标值,对PCR扩增效果有影响,但影响程度会因PCR设备不同厂家、不同型号有所差异。因此,对于温度偏差,设定多大数据作为设备校准判定合格与否的临界值,需根据设备品牌、型号给与不同的考虑。扩增程序如果控温时间整体较短,程序中温度的因素相对影响不大,但该结论还需更多的数据支撑。不同长度的片段在本次实验中没有发现扩增目的片段长度与温度调节敏感性的关系。 在反应池各孔的温度均匀性方面,无论试验中涉及的哪种品牌、哪种型号的设备,也无论是大豆基因片段亦或细菌毒理基因片段,反应板板位中间孔的温度具有更均匀的趋势。 另一方面,参编作者在恒温时间(Hold-Time)方面的实验结果显示,PCR仪器的恒温时间(Hold-Time)设定值与实际值之间偏差过大会对样品扩增结果的稳定性产生不良影响,甚至导致扩增实验未检出目的片段,或扩增产物发生基因错配,从而导致试验失败。因此,提示使用者应同时关注恒温时间(Hold-Time)及升降温速率对扩增结果的影响。 针对以上研究结论,提示检测实验室应通过检测过程的质量控制,及时发现上述风险,确保检测结果质量。 首先,对于反应板不同孔间不均匀性的影响,建议在试验中尽量将检测样品置于板位中间位置,减少仪器所造成的系统误差。为了监测和降低该风险,建议在试验中使用弱阳性质控,即在边缘容易产生温度偏差的孔设置弱阳性对照孔,监测扩增结果,若对照孔出现了扩增条带或CT值的明显减弱,则提示该批试验结果不可信。应核查孔间温度均匀性,进行设备维修和调试。对于整个反应板的温度偏离,同样可采用阳性对照或弱阳性对照的方式进行检测过程的质量控制来监测和降低风险。例如,在一个批次的检测中,根据各专业具体情况,即阳性、弱阳性对照品的可获得性和成本,选取若干孔设置阳性对照或弱阳性对照,监测扩增结果,若对照孔出现了扩增条带或CT值的明显减弱,则提示该批试验结果不可信。 对于恒温时间(Hold-Time)方面的影响,检测实验室需要关注PCR仪校准报告中恒温时间(Hold-Time)参数,如果该参数设定值与校准值偏差过大,需要在后续PCR实验过程中通过调整恒温时间(Hold-Time)来进行补偿。因此,对于检测实验室,PCR仪的定期校准和期间核查就显得十分重要。 除以上措施外,同时建议实验室定期对PCR仪进行校准和期间核查,有条件的实验室和进行关键试验之前建议对PCR仪的全参数(包括温度、光源、样本等)进行校准,实验室在获得PCR仪校准证书后,应进行校准结果的确认。即认真阅读和分析各项数据,结合PCR仪日常使用情况,核查和判断PCR仪是否满足使用要求。合理制定PCR仪的校准周期。如果认为有必要,还应进行期间核查,以准确掌握PCR仪是否具有良好的性能来支撑所有科学试验。

文章来源网络,如有侵权,请联系删除
